Cette équipe de neurologues et cancérologue du Brigham and Women's Hospital (BWH) a développé à la fois une méthode de diagnostic permettant d’identifier les récepteurs présents sur les cellules cancéreuses dans le sang, et une thérapie cellulaire, pour cibler et tuer les cellules tumorales restantes dans le cerveau, après la chirurgie, chez les patients atteints de glioblastome. Ces travaux qui constituent une grande avancée dans le traitement des cancers du cerveau agressifs, présentés dans la revue Nature communications, jettent déjà les bases de prochains essais cliniques.
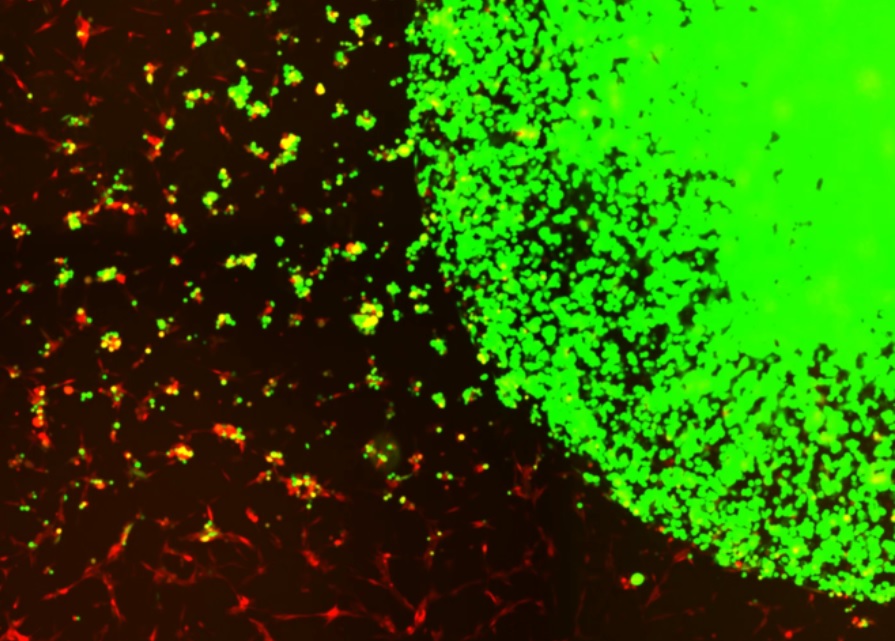
Ainsi, les cellules souches encapsulées (en vert) sur visuel, ciblent et éliminent les cellules tumorales de glioblastome (en rouge). Les glioblastomes (GBM) sont des tumeurs cancéreuses très agressives du cerveau et de la moelle épinière et très difficiles à traiter. En raison notamment de la barrière hémato-encéphalique, qui empêche de nombreux traitements anticancéreux d’atteindre le cerveau.
C’est aussi pourquoi 90 % des tumeurs de GBM réapparaissent après avoir été enlevées chirurgicalement, en dépit de la chimiothérapie et de la radiothérapie post-chirurgie.
Ici, l’équipe du Brigham and Women's Hospital et de la Harvard Medical School suggère et documente une nouvelle stratégie thérapeutique pour traiter les GBM après la chirurgie, en utilisant des cellules souches prélevées sur des donneurs sains, conçues pour attaquer les cellules tumorales spécifiques au GBM.
Cette nouvelle stratégie cellulaire démontre son efficacité contre le glioblastome,
ici sur des modèles précliniques : 100 % des souris modèles survivent plus de 90 jours après le traitement.
L’étude identifie les récepteurs cibles sur les cellules tumorales avant d'initier le traitement, puis teste une thérapie à base de cellules souches biodégradables, encapsulées dans un gel et prêtes à l'emploi post-chirurgie du GBM. L’auteur principal, le Dr Khalid Shah, directeur du Center for Stem Cell and Translational Immunotherapy (CSTI), vice-président de la recherche en neurochirurgie du BWH, et professeur à la Harvard Medical School relève le double avantage de la technologie, diagnostique et thérapeutique : « cette stratégie permet d’identifier rapidement les récepteurs cibles après un diagnostic de GBM, puis la mise en œuvre d’une thérapie à base de cellules souches, encapsulée dans un gel, prête à l'emploi ».
Une nouvelle approche standard « allogénique » : alors que de nombreuses thérapies cellulaires contre le cancer sont dérivées des propres cellules souches ou cellules immunitaires du patient, dans le cas du GBM, alors que la plupart des patients subissent une intervention chirurgicale au cours de la première semaine suivant le diagnostic, il reste peu de temps pour développer une thérapie spécifique à partir des cellules autologues. La nouvelle approche utilise des cellules souches allogéniques, ou des cellules provenant d'individus en bonne santé, la thérapie est donc en quelque sorte déjà disponible, et peut être administrée immédiatement au moment de la chirurgie.
Une capsule d'hydrogel biodégradable permet de transporter avec succès le traitement dans le cerveau, sans être emportée par le liquide céphalo-rachidien :
- les chercheurs ont d’abord identifié des récepteurs spéciaux dits « récepteurs de la mort » sur les cellules tumorales circulantes (CTC) dans le sang, en utilisant un biomarqueur génétique couramment exprimé sur les cellules tumorales ;
- une fois ces récepteurs identifiés, les scientifiques ont prélevé des cellules souches de la moelle osseuse de donneurs humains en bonne santé ;
- puis, ils ont modifié les cellules de manière à ce qu’elles libèrent une protéine qui se lie aux récepteurs de la mort et initient la mort cellulaire ;
- enfin, ils ont également intégré un interrupteur de sécurité dans le système des cellules souches qui permet de suivre les cellules souches par PET scan ; lorsque scan est activé, cela contribue à éradiquer les cellules souches tout en optimisant encore la mort des cellules cancéreuses.
De premiers tests précliniques concluants : testée chez des souris modèles de GBM, la nouvelle thérapie cellulaire injectée sous forme de gel thérapeutique permet la survie, 90 jours après le traitement, vs 55 jours pour les souris témoins. Aucun signe de toxicité n’est identifié, toujours chez la souris, avec ou sans tumeur.
Les essais cliniques de phase I chez des patients atteints de GBM sont proches. Avec de multiples applications en cas de validation, car la stratégie serait applicable à un plus large éventail de tumeurs solides.
Source: Nature Communications 19 May, 2022 DOI: 10.1038/s41467-022-30558-3 Target receptor identification and subsequent treatment of resected brain tumors with encapsulated and engineered allogeneic stem cells
- Plus sur les Cancers du cerveau
- Lire aussi : TUMEUR CÉRÉBRALE : Ils déverrouillent la barrière hémato-encéphalique
